自身免疫疾病是以局部或全身性异常炎症免疫反应为特征的炎症免疫性疾病,全球患者人群和药物规模都在增加,成为仅次于肿瘤的研发热门领域,药物研发数量上中国位列全球第二梯队。其中,TNFα、JAK、IL-23和IL-6R等为自身免疫性疾病领域较为热门且成熟的靶点。
礼来在自免领域也有诸多布局,靶点涉及JAK、IL-17和IL-23等。不仅有获批上市的口服JAK1/2抑制剂巴瑞替尼(Olumiant/Baricitinib)、IL-17单抗依奇珠单抗(Ixekizumab,Taltz)和米吉珠单抗(Mirikizumab),也有临床在研的lebrikizumab药物等,涉及类风湿性关节炎、严重斑秃、中重度特应性皮炎、银屑病等自身免疫疾病。
巴瑞替尼于2021年销售额首次超过十亿美元大关,销售额高达11.15亿美元,然而2022年,巴瑞替尼全球销售额下滑26%至8.3亿美元。依奇珠单抗自上市以来销售额稳步上升,2021年收入22.13亿美元,2022年销售额同比增加12%,达到24.82美元。Mirikizumab于今年在日本批准上市,但是被FDA拒绝批准,正在拓展其在儿童免疫疾病中的应用,有望开拓患者人群。
IL-12、IL-23和JAK-STAT信号通路
白细胞介素12(IL-12)和白细胞介素23(IL-23)是IL-12家族中的成员,由巨噬细胞、中性粒细胞和树突状细胞响应微生物和非微生物刺激产生的一种参与炎症过程的细胞因子,被认为与许多慢性免疫介导疾病有关。
IL-23由α和β亚基组成,由IL-23p19和IL-12p40两个亚基通过二硫键连接形成的异源二聚体细胞因子,其中IL-12与IL-23共享p40亚基。礼来有一款靶向IL-23p19亚基的获批上市的药物米吉珠单抗(Mirikizumab)。
IL-12R和IL-23R都与JAK成员JAK2和TYK2相互作用,激活JAK-STAT家族成员介导受体的特异性信号[1]。
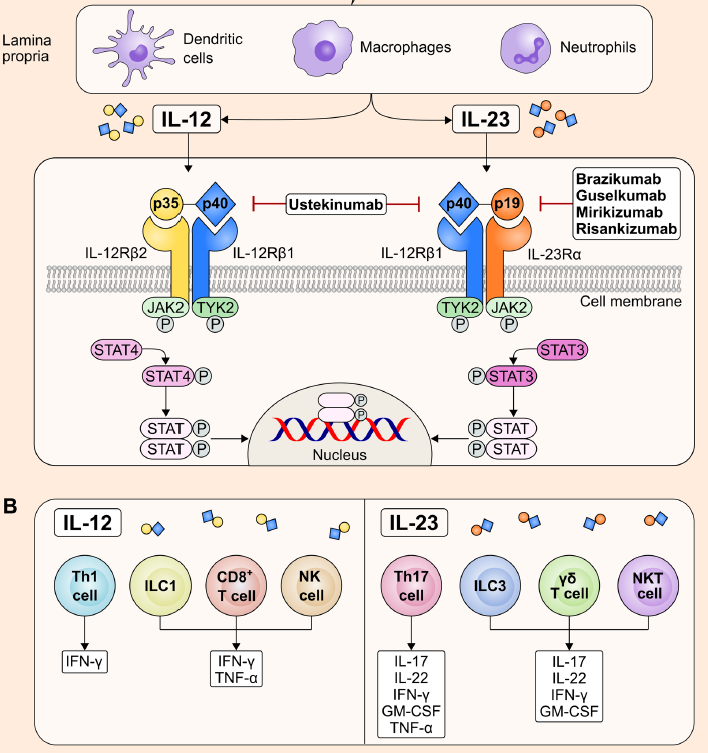
图1.IL-12、IL-23和JAK-STAT信号通路
Janus激酶(JAK)是一种非受体型酪氨酸蛋白激酶,由七个同源结构域(JH)组成,包括JAK1-3和TYK2四个成员[2],其中JAK1、JAK3更多负责免疫调节,而JAK2主要与红细胞和血小板的生成相关。JAK激酶介导的JAK-STAT通路是人体最重要的炎症通路之一,与多项自身免疫性疾病的发病相关,如类风湿关节炎、银屑病和炎症性肠病等。礼来在JAK领域有一款获批上市的药物巴瑞替尼(Baricitinib)。
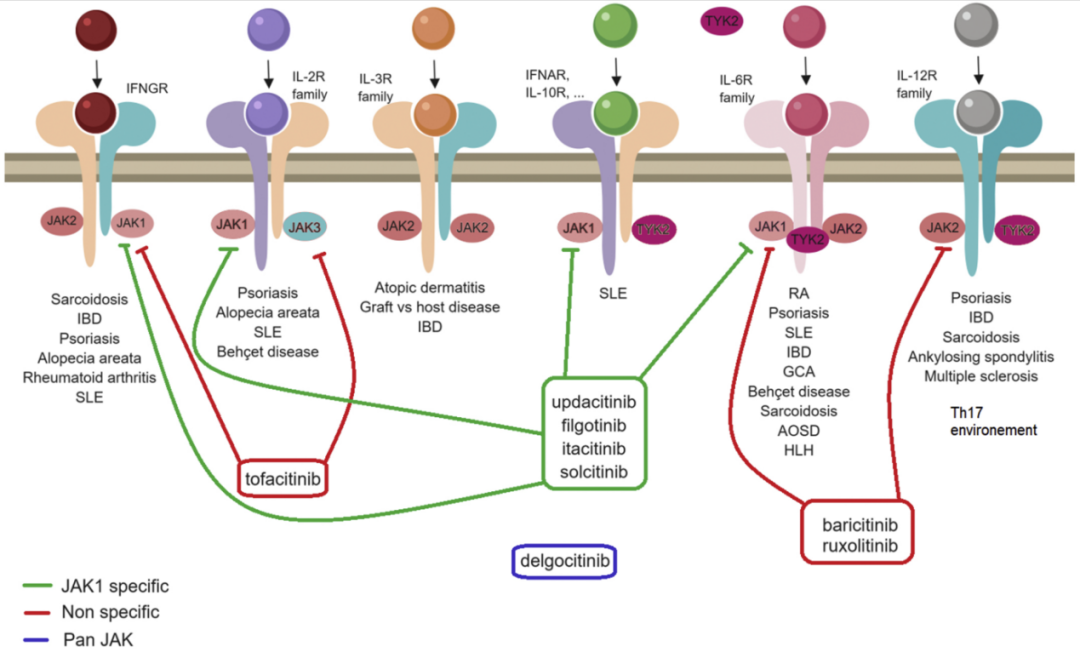
图2.JAK激酶成员、抑制剂以及介导的信号通路
靶向IL-23p19亚基药物Mirikizumab
目前全球有5款靶向IL-23新药获批上市,分别是强生的古塞奇尤单抗(Guselkumab,靶点IL-23p19)和乌司奴单抗(Ustekinumab,靶点IL12/23p40)、康哲药业引进的替瑞奇珠单抗(IL23p19)、艾伯维和勃林格殷格翰的利生奇珠单抗(risankizumab,靶点IL23p19)以及礼来的米吉珠单抗(Mirikizumab,靶点IL-23p19),其中古塞奇尤单抗、乌司奴单抗以及替瑞奇珠单抗在国内获批上市。
Mirikizumab是由礼来研发靶向结合IL-23的p19亚基的一种人源化IgG4单抗,于2023年3月在日本获批用于对常规治疗或疗法反应不足的中度至重度溃疡性结肠炎患者的诱导和维持治疗,并且是首个获批用于该适应证的IL-23p19抑制剂,但是4月13日FDA因对mirikizumab的拟生产制造过程存在一些疑问拒绝了mirikizumab用于治疗中重度溃疡性结肠炎的上市。
早在2020年6月10日,mirikizumab的新药进口注册已经被中国国家药监局药品审评中心(CDE)受理。今年5月5日,CDE官网最新公示,礼来递交了IL-23p19抑制剂mirikizumab的补充申请,用于维持治疗溃疡性结肠炎。
此前,mirikizumab在中重度溃疡性结肠炎患者中进行两项的3期LUCENT1和LUCENT-2诱导研究获得了积极结果。
LUCENT1试验中mirikizumab治疗12周达到临床缓解主要终点以及mirikizumab也达到降低肠道紧迫感、临床响应、内窥镜缓解、症状缓解以及内窥镜组织学炎症等所有关键次要终点。
在LUCENT-2研究中,对LUCENT-1受试者进行了为期一年的随访,结果表明:近半数(n=182/365)患者在接受mirikizumab维持治疗一年时获得临床缓解,而安慰剂组为(n=45/179,p<0.001)。
在靶向IL23药物中,乌司奴单抗处于一骑绝尘的地位,作为全球首个全人源“双靶向”IL-12和IL-23抑制剂,乌司奴单抗自推出后,安全良好的疗效和广大的市场需求赋予了其强劲的销售增速,远超同行业竞品。2022年,全球乌司奴单抗营收达到97.23亿美元,相较于2021年的91亿美元,增长了6%。2023年第一季度,该产品销售额为24.44亿美元,同比增长6.8%。Mirikizumab的上市时间远晚于乌司奴单抗和其他IL-23抑制剂,这可能会对其使用率产生影响。
Mirikizumab也在探索在儿童溃疡性结肠炎或克罗恩病患者中的研究(NCT05509777、NCT05784246、NCT04844606)(图3),可能获批用于治疗儿科人群,即扩展患者人群,这也使得mirikizumab不同于其他同类竞品,填补了该患者人群可用靶向治疗药物有限这一空白。除此之外,也在进行一些成人患者中的研究(图3)。

图3.Mirikizumab的临床试验(数据来源于clinicaltrials.gov数据库)
口服JAK1/2选择性抑制剂巴瑞替尼
巴瑞替尼是由Incyte开发的一种口服JAK1/2抑制剂,可阻断一种或多种JAK激酶家族成员的活性,从而抑制激活炎症的途径。2009年12月,礼来与Incyte达成合作开发和商业化该产品的协议,获得全球独占专利,交易总额高达7.55亿美元,包括9000万美元首付款和最高6.65亿美元里程金。
巴瑞替尼最早于2017年在欧盟和英国上市,获批适应症为类风湿关节炎,后又于2018年获得FDA批准被用于治疗某些患有中度至重度活动性类风湿关节炎的成年患者,2019年6月,巴瑞替尼2mg片剂(商品名艾乐明)被NMPA批准上市,用于治疗成人中重度活动性类风湿关节炎。
2022年6月13日,FDA批准了巴瑞替尼口服片剂用于治疗患有严重斑秃的成年患者,此次获批是FDA首次批准斑秃的全身疗法(即治疗全身而非特定部位),2023年3月,巴瑞替尼被NMPA批准,用于治疗成人重度斑秃。
总的来说,目前FDA已批准巴瑞替尼用于类风湿性关节炎、严重斑秃、中重度特应性皮炎、成人新冠中度和重度患者的治疗,NMPA只批准了类风湿性关节炎和严重斑秃两种适应症。
近期,在第25届世界皮肤科大会(WCD)上,几项评估巴瑞替尼单药或联合外用糖皮质激素(TCS)治疗对特应性皮炎(AD)患者瘙痒的3期研究披露了临床结果:与安慰剂相比,巴瑞替尼单药或联合TCS治疗16周,AD患者可以达到无瘙痒或几乎无瘙痒的程度。并且早在第2周,即有部分患者可达到此效果。
作为首款上市的JAK抑制剂芦可替尼在JAK抑制剂中的销售额遥遥领先,由于上市时间较晚,巴瑞替尼的销售额刚开始较低,2019年销售额为4.269亿美元,2020年,由于获批新冠肺炎(Covid-19)紧急使用授权,巴瑞替尼销售收入增长50%,达6.39亿美元,2021年销售额高达11.15亿美元,然而2022年,巴瑞替尼全球销售额达8.3亿美元,同比下滑26%,销售额的下滑与类风湿性关节炎市场格局持续加剧有关,不过巴瑞替尼获批了斑秃新适应症,不知能否挽回2023年销售额。
巴瑞替尼的化合物专利将在2029年3月到期,在国内,南京优科制药于2021年8月3日率先提交了巴瑞替尼片的新3类仿制药上市申请,有望成为国内首仿、首家过评的品种。
巴瑞替尼针对其他适应症的多项临床试验也在进行中,如银屑病、特应性皮炎、类风湿性关节炎和免疫性血小板减少症等(图4)。
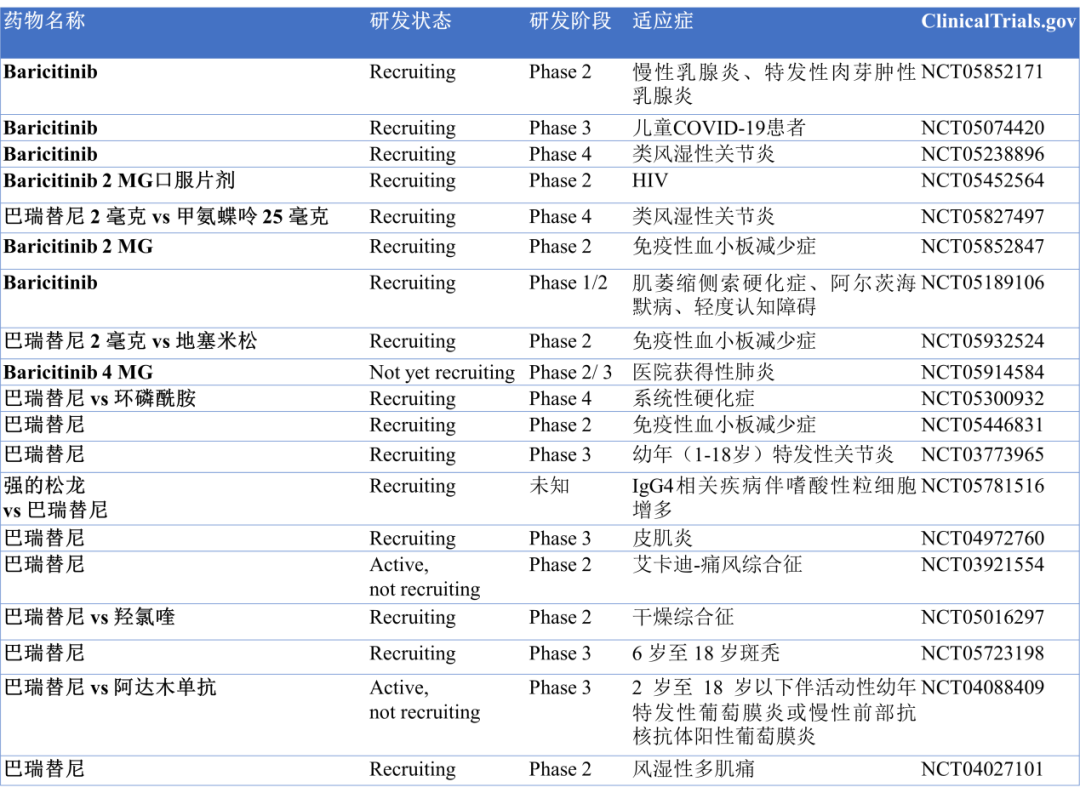
图4.巴瑞替尼的部分临床试验(数据来源于clinicaltrials.gov数据库)
IL-17家族
IL-17A是IL-17家族的原型细胞因子,参与正常的炎症和免疫反应,它在斑块状银屑病,银屑病关节炎和强直性脊柱炎等的发病过程中起关键作用。IL17家族有6成员,包括IL-17A(IL-17)、IL-17B、IL-17C、IL-17D、IL-17E(IL-25)和IL-17F。IL-17受体家族由五种不同的受体IL-17R/IL-17RA,IL-17BR/IL-17RB,IL-17RC,IL-17RD/SEF和IL-17RE组成,它们具有共同的细胞质基序称为SEFIR(成纤维细胞生长因子)域。IL-17RA是所有其他受体的共同亚基,也包括抑制性CBAD(C/EBPβ激活)结构域[3]。
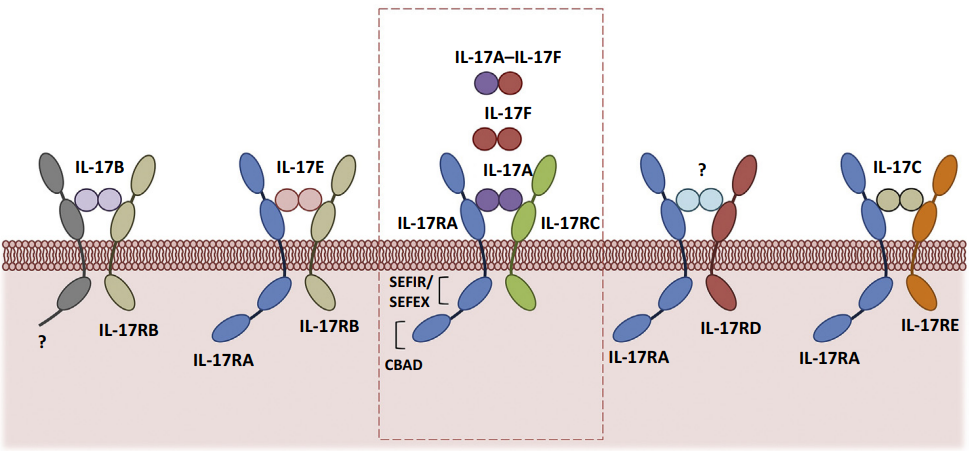
图5.IL-17细胞因子和受体家族
IL-17信号传导通过调节大多数非造血区室细胞中炎症基因的表达来控制炎症。图6A是IL-17调控的常见炎症基因。图6B列出其他地方的基因对各自的组织区室具有特异性,并且在介导组织特异性IL-17依赖性炎症。
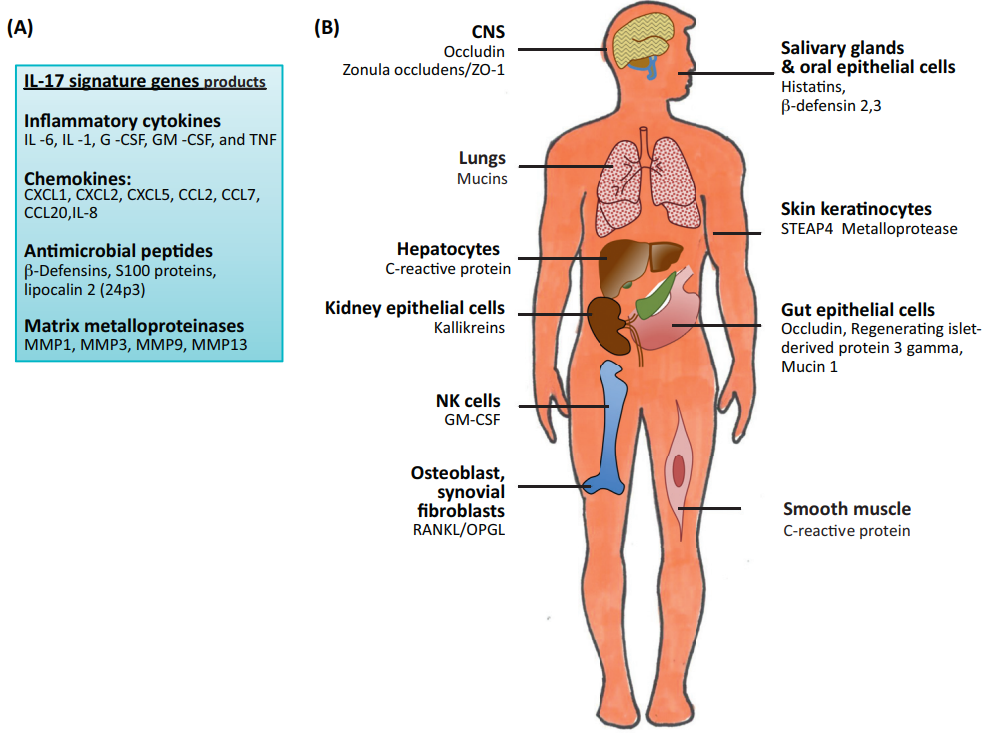
图6.IL-17调控的主要炎症基因
靶向IL-17药物依奇珠单抗
目前全球范围内共上市5款靶向IL-17A/IL-17RA药物,分别是诺华的司库奇尤单抗(Secukinumab,Cosentyx)、礼来的依奇珠单抗(Ixekizumab,Taltz)、Biocad的尼塔奇单抗(Netakimab,Efleira)、优时比(UCB)的比吉利珠单抗(Bimekizumab)和安进和阿斯利康开发的布罗利尤单抗(brodalumab)。其中司库奇尤单抗、依奇珠单抗和布罗利尤单抗已在国内获批,比吉利珠单抗也已在国内申报上市。
依奇珠单抗是由礼来开发的一种靶向IL-17A的人源化`lgG4单克隆抗体,于2016年3月首次获得FDA批准。目前,该药已获FDA批准治疗多种疾病,包括强直性脊柱炎、中度至重度斑块状银屑病和活动性银屑病关节炎(PsA)等。依奇珠单抗于2019年9月被NMPA批准,用于治疗适合系统治疗或光疗的中度至重度斑块型银屑病成人患者。
在上市的5款药物中,司库奇尤单抗和依奇珠单抗销量最好,自上市以来,依奇珠单抗销售额快速增长,2021年收入22.13亿美元,2022年销售额达到24.82美元,同比增长12%(图7)。
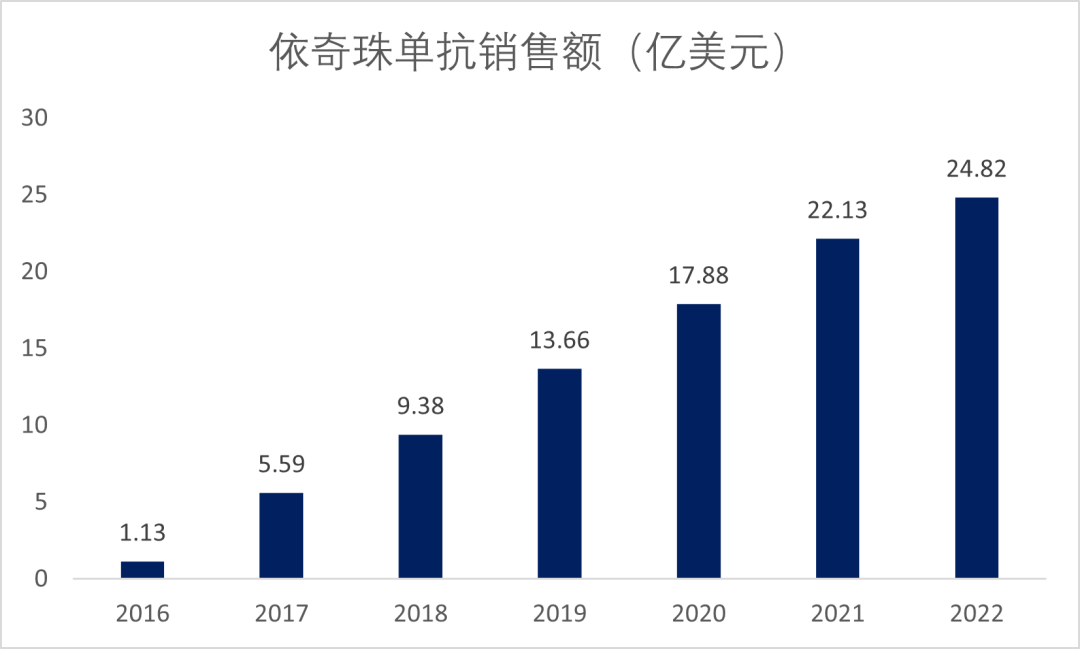
图7.依奇珠单抗的销售额
依奇珠单抗多项临床试验表明其治疗银屑病患者达到很好的效果(图8)。总的来说,治疗1周即可实现皮损和瘙痒症状显著改善;治疗60周,55%的患者达到银屑病皮损面积及严重程度指数(psoriasisareaandseverityindex,PASI)100,持续用药,皮损清除效果可稳定维持至少4年。
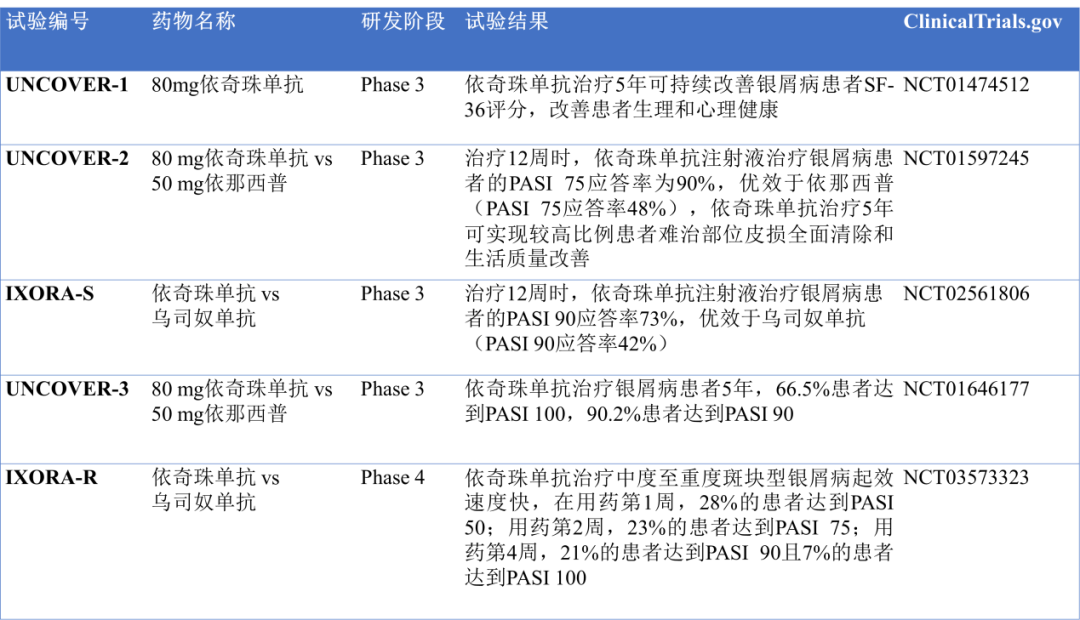
图8.依奇珠单抗的部分临床结果。标注:在斑块型银屑病临床试验中,PASI75(≥使银屑病面积和严重程度指数减少75%)传统上一直是治疗效果的基准。(数据来源于clinicaltrials.gov数据库)
除此之外,依奇珠单抗还有一些临床在研的试验,如图9所示。
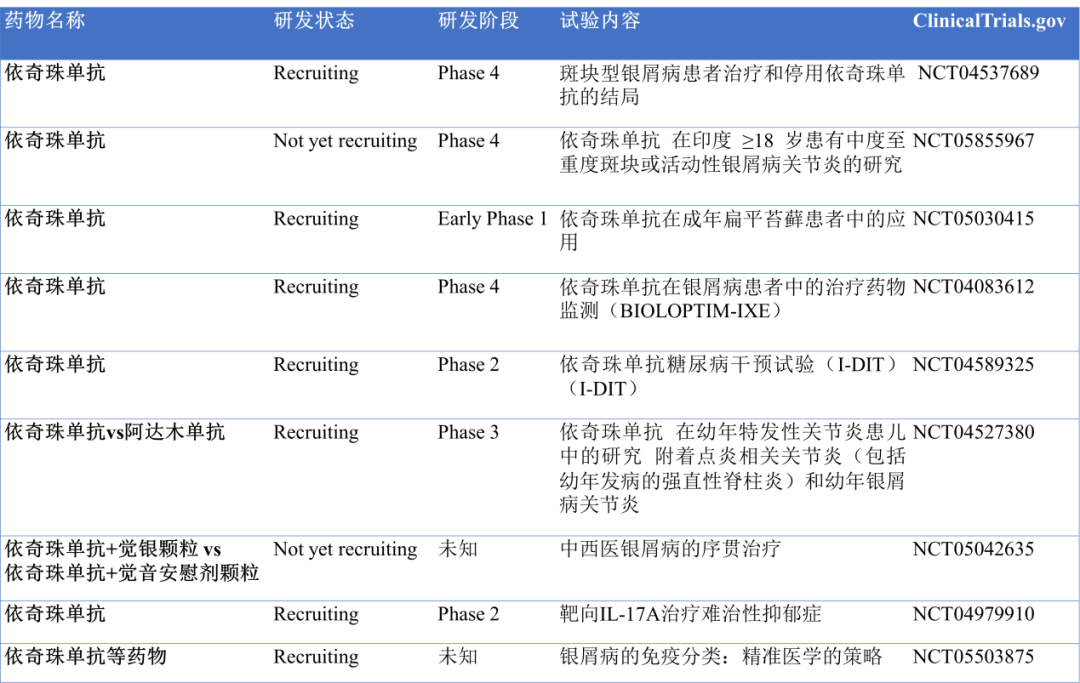
图9.依奇珠单抗部分临床在研试验(数据来源于clinicaltrials.gov数据库)
依奇珠单抗是皮下注射给药方式,相对于皮下注射给药,口服给药方式更能被患者所接受,所以近期礼来花24亿美元收购了DICETherapeutics,该公司拥有口服IL17小分子拮抗剂DC-806和DC-853,扩充其在免疫领域管线。
小结
在今年4月底,礼来公布了替尔泊肽的SURMOUNT-2试验结果,基于此项积极的试验结果礼来的市值飙升,达4200亿美元,超越强生成为全球市值最高的制药公司。
作为纯药企市值第一的大药企,礼来的研发管线众多,涉及糖尿病和肥胖症、肿瘤、神经领域和免疫四大疾病领域。
在免疫领域涉及的靶点包括JAK、IL-17和IL-23等,拥有口服JAK1/2抑制剂巴瑞替尼、IL-17单抗依奇珠单抗以及IL-13单抗Mirikizumab等。
在这些药物中,依奇珠单抗的销售额最高,自上市以来销售额稳步增长,2022年销售额达到24.82美元,巴瑞替尼于2021年销售额首次超过十亿美元大关,销售额高达11.15亿美元,然而2022年,巴瑞替尼全球销售额下滑26%至8.3亿美元。Mirikizumab于今年在日本被批准上市,然而于被FDA拒绝批准上市,Mirikizumab目前开发在儿童溃疡性结肠炎或克罗恩病患者中的研究,如果获批,会扩展患者人群,这也使得mirikizumab不同于其他同类竞品,增加其竞争性。
除此之外,礼来也在其它免疫靶点进行布局,如处于临床3期的用于治疗中度至重度特应性皮炎新型抗炎药IL-13抑制剂lebrikizumab,自免是一个很大的疾病领域,全球各大药企纷纷布局,礼来也不甘示弱,布局的种类相信会越来越多。



